めっきの知識

電気めっきのメカニズム
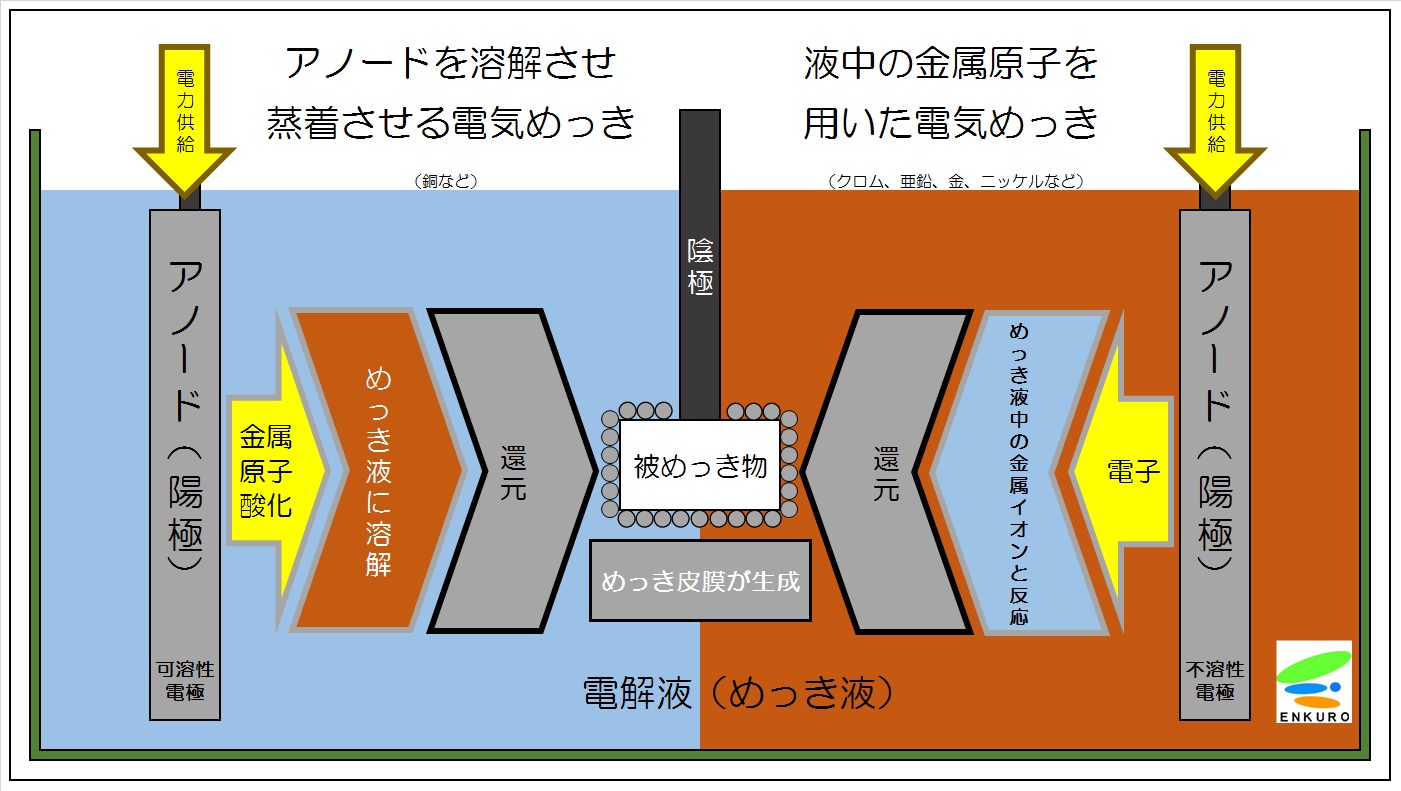
電気めっきとは、めっきしたい金属イオンを含む水溶液中で、めっき処理品を陰極(-極)、めっきしたい金属を陽極(+極)として電解するものです。
電気めっきのメカニズムは上記の絵図に示すように、
陰極では還元反応が起こり、
金属が析出してめっき膜として成長します。
還元反応とは、
陰極(めっきしようとする製品)の表面で、めっき液中の金属イオン(金属がめっき液に溶けている状態)が、直流電流(電子)によってイオンから(電荷を失って)金属になる反応です。
この反対が、陽極で起こる酸化反応で、金属がめっき液に溶けて、金属イオンになる反応です。
この二つの反応は陰極と陽極で同時に起きます。
すなわち、電解液中の金属イオン〔Mn+〕が電子〔ne-〕をもらって金属〔M〕として表面に析出します。
陽極では酸化反応が起こり、めっき液中に陽極の金属が溶解してめっき液中の金属イオンが補給されます。
このように、めっきしたい金属を陽極にする場合は、その陽極は電解液に溶解しますから、
可溶性電極とよんでいます。
これに対して、めっき液に溶解しない陽極(不溶性電極)も使用されています。
この場合の金属イオンの補給は、化学薬品で行います。
電気めっきにおける特性ですが、
平面よりも角や尖った箇所にめっき皮膜が析出されやすく、
逆に奥まった箇所や複雑な形状の底部にはめっきが着きづらい性質を持っています。
電気めっきと名前のとおり、
雷が先端に落ちやすいというのをイメージするとわかりやすいかもしれません。
電気めっきのメカニズムは上記の絵図に示すように、
陰極では還元反応が起こり、
金属が析出してめっき膜として成長します。
還元反応とは、
陰極(めっきしようとする製品)の表面で、めっき液中の金属イオン(金属がめっき液に溶けている状態)が、直流電流(電子)によってイオンから(電荷を失って)金属になる反応です。
この反対が、陽極で起こる酸化反応で、金属がめっき液に溶けて、金属イオンになる反応です。
この二つの反応は陰極と陽極で同時に起きます。
すなわち、電解液中の金属イオン〔Mn+〕が電子〔ne-〕をもらって金属〔M〕として表面に析出します。
陽極では酸化反応が起こり、めっき液中に陽極の金属が溶解してめっき液中の金属イオンが補給されます。
このように、めっきしたい金属を陽極にする場合は、その陽極は電解液に溶解しますから、
可溶性電極とよんでいます。
これに対して、めっき液に溶解しない陽極(不溶性電極)も使用されています。
この場合の金属イオンの補給は、化学薬品で行います。

電気めっきにおける特性ですが、
平面よりも角や尖った箇所にめっき皮膜が析出されやすく、
逆に奥まった箇所や複雑な形状の底部にはめっきが着きづらい性質を持っています。
電気めっきと名前のとおり、
雷が先端に落ちやすいというのをイメージするとわかりやすいかもしれません。
